Hóa học 11 KNTT Bài 5: Ammonia - Muối ammonium
1.1. Ammonia
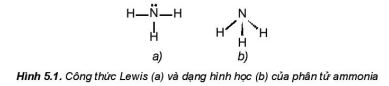
a. Cấu tạo phân tử
|
Phân tử ammonia được tạo bởi một nguyên từ nirogan liên kết với ba nguyên tử hydrogen và có dạng hình học là chóp tam giác: |
- Phản ứng trên là giai đoạn trung gian quan trọng trong quá trình sản xuất nitric acid theo phương pháp Ostwald (Ot-xvan).
d. Ứng dụng
- Tác nhân làm lạnh.
- Dung môi.
- Sản xuất nitric acid.
sản xuất phân đạm.
e. Sản xuất
- Trong công nghiệp, quá trình sản xuất ammonia thường được thực hiện ở nhiệt độ 400°C – 450°C, áp suất 150 – 200 bar, xúc tác Fe.
N2(g) + 3H2(g) \(\rightleftharpoons\) 2NH3(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) = -91,8 kJ
1.2. Muối ammonium
a. Tính tan, sự điện li
−Một số muối ammonium phổ biến: NH4Cl, NH4CIO4, NH4NO3, (NH4)2SO4, NH4H2PO4 (NH4)2HPO4, NH4HCO3, (NH4)2Cr2O7.
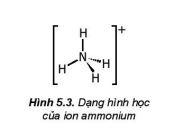
− Hầu hết các muối ammonium đều dễ tan trong nước và phân li hoàn toàn ra ion.
Ví dụ: NH4Cl \(\to\) NH4+ + Cl-
b. Tác dụng với kiềm – Nhận biết ion ammonium
− Khi đun nóng hỗn hợp muối ammonium với dung dịch kiềm, sinh ra khí ammonia có mùi khai.
Ví dụ: (NH4)2SO4 + 2NaOH \(\xrightarrow{{{t}^{o}}}\) Na2SO4 + 2NH3 + 2H2O
− Phương trình ion rút gọn: NH4+ + OH- \(\xrightarrow{{{t}^{o}}}\) NH3 + H2O
c. Tính chất kém bền nhiệt
Các muối ammonium đều kém bền nhiệt và dễ bị phân huỷ khi nung nóng.
NH4Cl \(\xrightarrow{{{t}^{o}}}\) NH3 + HCl
NH4HCO3 \(\xrightarrow{{{t}^{o}}}\) NH3 + CO2 + H2O
NH4NO3 \(\xrightarrow{{{t}^{o}}}\) N2O + 2H2O
d. Ứng dụng
− Chất đánh sạch bề mặt kim loại
− Thuốc long đờm
− Phân bón hoá học
− Chất phụ gia thực phẩm
− Thuốc bổ sung chất điện giải